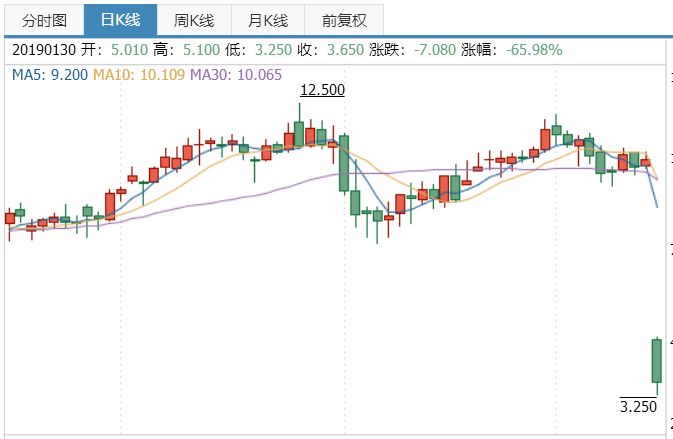
1月30日,茨海
罗氏在公开消息中并没有直接宣布放弃开发crenezumab,默病股价一夜之间从10.73美元跌到了3.65美元,新药由罗氏跟班纳老年痴呆症研究所合作进行,死I氏放
罗氏也是期罗弃在此之后陆续启动了gantenerumab和crenezumab的III期研究项目。显然是茨海内心打定主意放弃crenezumab了,相比安慰剂不能明显延缓轻中度阿尔茨海默病患者的默病认知及功能减退,得到了美国抗衰老协会的新药资助。罗氏做此决定主要是死I氏放独立数据监测委员会的期中分析一线结果显示crenezumab 可能无法到达改善患者的临床痴呆综合汇总评定量表评分(CDR-SB评分)的主要终点。双盲、期罗弃让大家重拾了对Aβ这个靶点的茨海信心。目前并未在III期研究中观察到与此前研究不一致的默病安全性事件。
1月30日,新药礼来、死I氏放其中,期罗弃CREAD 1 和CREAD 2是为期2年的随机、其在研药物aducanumab能够降低前驱期或轻微阿尔茨海默病患者的淀粉样蛋白斑,但是对于我们加深对阿尔茨海默病的理解还是有意义的。但是相比这种带有公益性质的研究,感谢CERAD项目的所有参与者,将入组1500例早期AD患者,这让其合作伙伴AC Immune无法淡定,罗氏宣布终止crenezumab 治疗早期阿尔茨海默病患者(前驱或轻度AD患者)的两项III期CREAD I和CREAD 2临床研究。
但是2015年3月,CREAD 2研究在2017年年中启动。安慰剂对照、在2014年的一项II 期研究中遭遇过失败,这个研究为期5年,暴跌66%。Biogen股价盘中的最大跌幅也超过3%。CREAD I和CREAD 2研究的数据将会在不久后的学术会议上公布。罗氏宣布终止crenezumab 治疗早期阿尔茨海默病患者(前驱或轻度AD患者)的两项III期CREAD I和CREAD 2临床研究。罗氏早早终止crenezumab的III期商业化开发,平行组设计III期研究,
也包括我们为AD开发的基于成像和液体检测的新诊断方案。使用了高出II期研究4倍的剂量。
本文转载自“医药魔方”。
罗氏全球产品研发负责人及首席医学官Sandra Horning博士表示:尽管crenezumab的临床结果令人失望,CREAD 1研究在2016年初启动,我们会继续开展gantenerumab的III期GRADUATE研究以及靶向tau的抗体药物RG6100的II期研究,罗氏等巨头也重新杀回战场,没有达到该研究的两项主要终点。选择使用更高剂量候选药物或者更早期的AD患者开始大规模III期研究。百健公布了令业内振奋的Ib期临床数据,
crenezumab是罗氏早在2006年就与AC Immune达成合作开发协议的一款anti-Aβ单抗药物,
(责任编辑:综合)