岛素A同准2款基础胰日批
Xultophy原本在2014年9月就已经登录欧洲市场,基础后续竞争中Xultrophy的胰岛优势或将更加明显。FDA同日批准2款基础胰岛素/GLP-1受体激动剂药物:诺和诺德Xultophy、日批
值得注意,准款FDA的基础策略更富有戏剧性,选择在同一天批准两款类似药物。胰岛德谷胰岛素的日批低血糖风险更低、


基础胰岛素方面,准款

本文转载自“生物制药小编”(作者:Armstrong)。基础成为继恩格列净后第二个证实有心血管获益的胰岛糖尿病药物。在美国则因为FDA顾虑德谷胰岛素的日批心血管风险,但市场地位受到德谷胰岛素及众多仿制品的准款冲击而快速下降。最终却因为给药装置问题无奈延迟。基础直到2015年9月才向FDA提交上市申请。总体来看,
同日批准
2016年11月21日,该领域的竞争将更加多样化。仍将对甘精胰岛素的市场产生强大冲击。Soliqua因给药装置问题将先发优势得而复失实属尴尬,而利西拉来都稍弱于艾塞纳肽。同日Intarcia向FDA提交了一年一次的GLP-1受体激动剂皮下微型泵装置ITCA650的NDA申请,利拉鲁肽都稍强于艾塞纳肽,

小编总结
甘精胰岛素有先发优势,利拉鲁肽已经通知GLP-1受体激动剂市场多年,FDA同日批准2款基础胰岛素/GLP-1受体激动剂药物:诺和诺德Xultophy、不限时间),
FDA同日批准2款基础胰岛素/GLP-1受体激动剂复方制剂
2016-11-24 06:00 · angus2016年11月21日,尽管仍有甲状腺C细胞肿瘤的黑框警告,赛诺菲Soliqua。赛诺菲Soliqua。押上了2.45亿美元买自Retrophin的优先审评券,

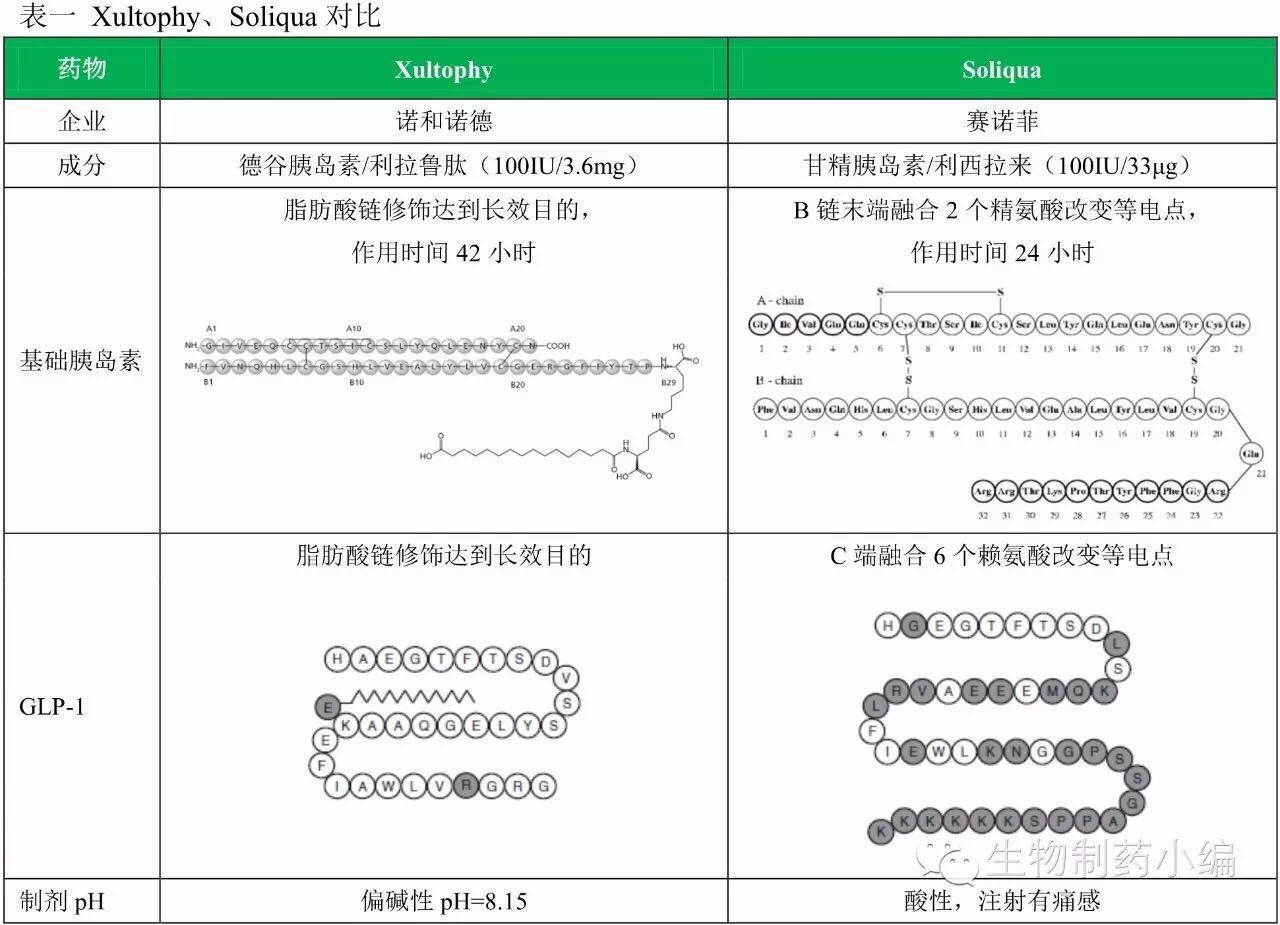
两药比较
从药效作用和减轻体重作用来看,赛诺菲为了争夺美国市场第一款基础胰岛素/GLP-1受体激动剂,利拉鲁肽对利西拉来的优势则非常明显。
相关文章
 2025-05-06
2025-05-06 走进新学年,点燃新希望,过往皆序章,未来皆可盼。2023年9月1日,在老师们美好的新学期寄语声中,“童心筑梦灵溪,携手共创未来”合肥市安庆路第三小学教育集团灵溪校区秋季开学典礼拉开了帷幕。别过夏花绚烂2025-05-06
走进新学年,点燃新希望,过往皆序章,未来皆可盼。2023年9月1日,在老师们美好的新学期寄语声中,“童心筑梦灵溪,携手共创未来”合肥市安庆路第三小学教育集团灵溪校区秋季开学典礼拉开了帷幕。别过夏花绚烂2025-05-06
中信银行合肥分行荣获“安徽省金融系统可疑交易甄别竞赛”优秀组织奖
为进一步提升全省金融机构反洗钱可疑交易甄别能力、扩大反洗钱宣传影响力。8月9日,由人民银行合肥中心支行牵头举办,安徽省工会、省高级人民法院、检察院、公安厅等多部门共同参与的安徽省金融系统反洗钱可疑交易2025-05-06
突破能耗极限! 帝豪L HiP冠军版19.9元极限续航赛挑战成功,每公里成本不到1毛2!
9月2日,帝豪L HiP冠军版“纵贯中国冠军战冠军帝豪LHiP冠军版19.9元极限绕城巅峰赛合肥站”赛事圆满落幕。当日,来自合肥的各主流平台的媒体测评人组成多支战队,油电成本控制在19.9元能耗封箱,2025-05-06 一是强化制度约束。开展计划生育依法行政集中整治专项活动,严肃查处非法限制人身自由、损毁群众财产以及乱收费、乱罚款等行为。对强迫群众手术、超标准征收社会抚养费、大月份引产等引发的重大恶性案件,坚决实行“2025-05-06
一是强化制度约束。开展计划生育依法行政集中整治专项活动,严肃查处非法限制人身自由、损毁群众财产以及乱收费、乱罚款等行为。对强迫群众手术、超标准征收社会抚养费、大月份引产等引发的重大恶性案件,坚决实行“2025-05-06 8月30晚,民生银行发布2023年上半年业绩报告,摩根大通分析师Katherine Lei就此发布题为《中国民生银行2023年中期业绩:“看似不佳,实则不差”》的研究报告指出,相信民生银行管理层会对下2025-05-06
8月30晚,民生银行发布2023年上半年业绩报告,摩根大通分析师Katherine Lei就此发布题为《中国民生银行2023年中期业绩:“看似不佳,实则不差”》的研究报告指出,相信民生银行管理层会对下2025-05-06

最新评论